■希土類元素(レアアース)とは
希土類元素(レアアース)とは、原子番号57のLa(ランタン)から71のLu(ルテチウム)までの15元素(ランタノイド)と、21のSc(スカンジウム)、29のY(イットリウム)を加えた17元素です。ScとYは4f電子をもたず、発光や磁気に関与しないので、以降はランタノイドのみを希土類元素(レアアース)と称します。(表1. 参照)。
レアアースと呼ばれていますが、実はPm(プロメチウム)以外は地球上に豊富に含まれています。Ce(セリウム)にいたっては銅よりも埋蔵量が多いとされています。なぜそう呼ばれているかというと、希土類元素(レアアース)は同等の遷移金属源と比べて採掘および抽出が困難であったからと言われております。現在はイオン交換、分離結晶、液抽出などの技術が確立されてきたため、昔に比べれば容易に得ることが可能になりましたが、環境対策などの課題が多く事業者が少ないため、比較的に高額になる傾向があります。
希土類元素(レアアース)は現代社会を支えるさまざまな分野で使用されており、光ファイバ、レーザ、増幅器、蛍光体、強力磁石、光磁気ディスク、排ガス浄化用・還元触媒、磁性半導体など、特に自動車や家電には必ずと言っていいほど使用されています。そのため、現在世界の約97%の生産量を中国に依存している状況が問題視されており、他の輸入先の開拓、希土類元素(レアアース)の使用量の削減、代替材料の開発などが積極的に行われております。
表1. 周期表でみる希土類元素(レアアース) 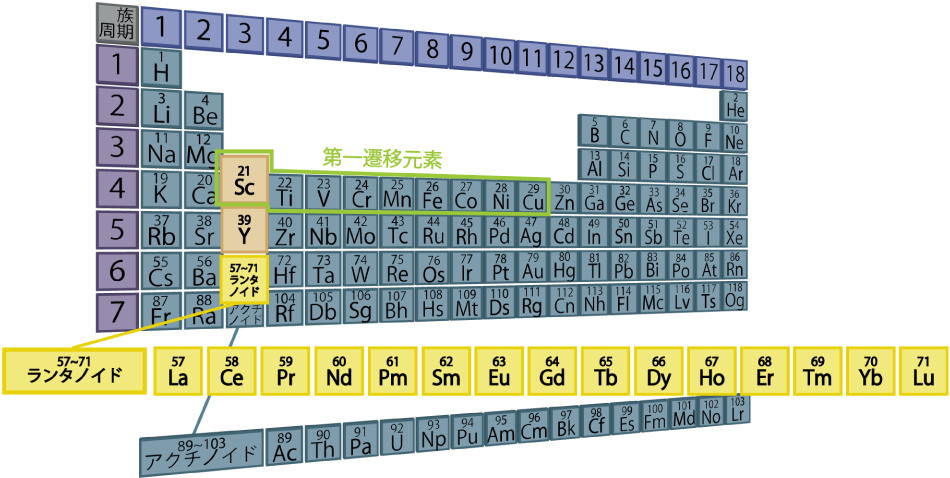
現在、周期表に並んでいる元素の数は118種類ですが、発光する元素は希土類元素(レアアース)と第一遷移元素(原子番号21のScから29のCu)に集中しています。これらの元素に共通するのは内殻軌道に不対電子をもつことです。この不対電子の働きによって発光が起こったり磁気モーメントが生じます。
■不対電子とは
物質の最小単位である原子は原子核とその周りを回っている電子から成り立っています。電子は原子核のまわりのs軌道、p軌道、d軌道、f軌道といった電子軌道に配置されており、電子配置の違いによって物質固有の性質が出現します。1つの軌道には2個の電子を収容できますが、軌道に1個しか収容されていない電子を不対電子といいます。希土類元素(レアアース)は4f軌道に不対電子をもっており、第一遷移元素は3d軌道に不対電子をもっています。
不対電子は光や電気などのエネルギーをもらって他の軌道に一時的に移ることができます。そして、元の軌道に戻るときにもらったエネルギーを光として放出します(図1. 参照)。これが発光の原理です。

図1.励起エネルギーによる発光
世界初の固体レーザーは第一遷移元素のCrを発光中心に使ったルビーレーザーですが、今では、Nd-YAGレーザーやYbファイバレーザーをはじめ殆どの固体レーザーやファイバレーザーには発光効率の良い希土類元素(レアアース)が利用されています。また、光通信に欠かせない光増幅器(光アンプ)にも希土類元素をドープした光ファイバが使われています。
軌道に2コのペアで入っている電子はスピンの向きが逆なのでので打ち消しあって磁気を発生することはありませんが、1コの場合は電子のもっている角運動量に応じて磁気が発生します。Nd磁石やSmCo磁石などの希土類磁石は超強力磁石として今では産業に欠かせない磁石ですし、Fe、Co、Niなどの第一遷移元素は昔から磁石材料としてよく知られているところです。
■希土類元素(レアアース)の電子配置の特徴
表2は希土類元素(レアアース)と希土類3価イオンの電子配置を示しています。希土類元素の電子配置を希ガス元素のXe(キセノン)と比べてみます。1s, 2s・・・4dと5s, 5d軌道はXeと全く同じで全ての軌道に2個づつ電子が入っています。希土類元素では、さらに外殻の6s軌道に電子が入った後に4f軌道に電子が入っていきます。軌道の数は、s軌道が1、p軌道が3、d軌道が5、f軌道が7です。La, Ce, Gd, Luでは5d軌道にも1個の電子が入っています。このように、外殻軌道に先に電子が入り、後から電子が入っていく内殻の4f軌道をもっていることが希土類元素の特徴で、不対電子をもつ理由です。
原子が結合して物質をつくるとき、外殻電子を使ってイオン結合や共有結合をつくります。希土類元素は物質中では殆ど3価イオンで存在しますので、物質中での挙動は3価イオンの電子配置によります。3価イオンでは、6sと5dの電子は全てなくなり、さらに足りない場合は4f電子を加えた計3個の電子を供出しています。外殻の5s, 5pの電子配置は全ての希土類イオンで同じです。そのため、希土類イオンはみな非常によく似た性質を示します。また、原子番号が増えるに従い内殻の4f電子が1コづつ増えていきます。4f電子が原子核に強く引き付けられるので原子番号が大きくなる程イオンサイズが小さくなっていく「ランタノイド収縮」という特有な現象が生じます。
表2. 希土類元素と3価イオンの電子配置 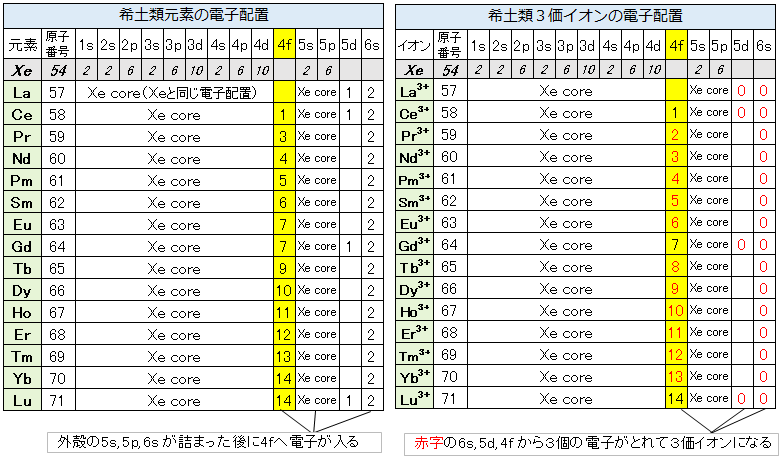
■4f軌道の電子配置
希土類イオンの特徴は内殻の4f軌道に不対電子をもつことですが、4f軌道にどのように電子が配置されているか、表3に従ってみてみます。La3+は4f 軌道に電子がなく、Lu3+は7つの軌道が全て2個のペア電子で埋まっていて不対電子がないので表から除外してあります。
表3. 希土類3価イオンにおける基底状態の4f電子配置 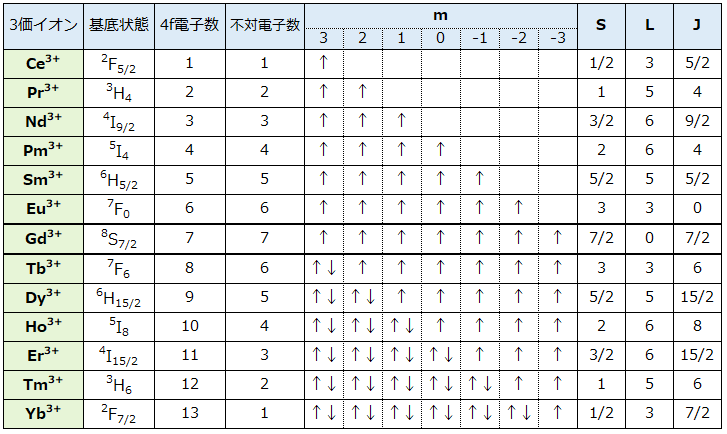
4f軌道には方位の違う7つの軌道があり、各軌道の角運動量のXYZ軸上のZ成分の違いを示す磁気量子数 m=3, 2, 1, 0, -1, -2, -3で区別します。Hundの規則に従って、CeからGdにかけてこれらの軌道に上向きスピンの電子が磁気量子数mの大きい方から1コづづ入っていき、Gdで不対電子7コになります。TbからYbにかけては下向きスピンの電子が入ってペアを作っていくので不対電子の数は減少していきYbで1コになります。表3の電子配置は最もエネルギーの低い電子配置でこの配置を基底状態といいます。
表3には磁気量子数mに続いて、S, L, Jという欄がありますが、S, L, Jは何れも角運導量です。
Sはスピン角運動量といい、4f電子のスピンの和となります。1コの上向きのスピンを(+1/2)、下向きを(-1/2)と表します。Pr3+は上向きのスピン2コですのでS=(+1/2)x2=1、Er3+は上向き7コと下向き4コなのでS=(+1/2)x7+(-1/2)x4=3/2となります。
Lは全軌道角運動量といい、磁気量子数mの和です。Pr3+はm=3に1コ、m=2に1コの不対電子があるのでL=3+2=5、、Er3+はm=-1, -2, -3に1コづつ不対電子があるのでL=∣(-1)+(-2)+(-3)∣=6となります。
Jは全角運動量といい、全軌道角運動量Lとスピン角運動量Sを合成したものです。合成の仕方は、Ce ~Euの軽希土類ではJ=L-S、Gd~Ybの重希土類ではJ=L+Sになります。例えば、PrではJ=5-1=4、ErではJ=6+3/2=15/2です。
表3の基底状態の欄にある記号はスペクトル項あるいは単に項記号と呼ばれ、各イオンの電子配置を角運動量で表しています。この記号は図2のような意味を持っています。アルファベットLは表3のLで示す全軌道角運動量です。表3では数字になっていますが、L=0, 1, 2, 3, 4, 5, 6,・・・・に対応してS, P, D,F, G, H, I,・・・・に置き換えて表示します。左上の数字は2S+1で表されるスピン多重度で、例えばS=1だと3になり3重に縮重した状態で、スピン軌道相互作用により3つに分裂することが分かります。右下は全角運動量Jで、縮重は(2J+1)となります。
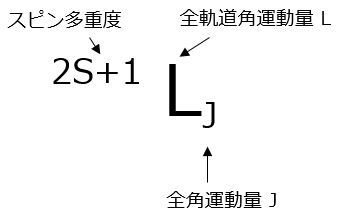
図2.基底状態の欄にある記号(項記号)
■希土類イオンのエネルギー準位
4f電子の配置には基底状態だけでなく可能な電子配置がたくさんあります。これらの状態はクーロン相互作用(電子間の反発)で全軌道角運動量の異なる軌道が分裂し、分裂した各軌道はさらにスピン軌道相互作用(スピン角運動量と軌道角運動量の結合の仕方)により分裂し、さらに結晶場により細かく分裂します(図3参照)。分裂した軌道のエネルギーを低い順に下から並べたのがエネルギー準位図で、これら分裂した4f軌道間の電子遷移によって発光が起こります。どのように分裂するかは各イオンがもつS, L, Jにより異なりますので希土類の種類によって異なる準位ができ、その結果異なる波長の発光を得ることができます。
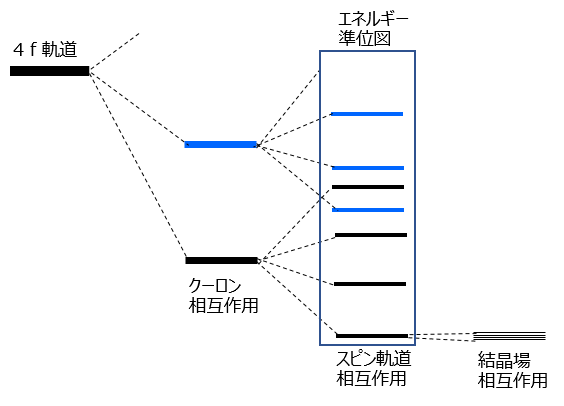
図3.4f軌道の分裂とエネルギー準位図
基底状態がスピン軌道相互作用でどのように分裂するのかPr3+、Er3+、Yb3+の例をみてみます。Pr3+, Er3+は光増幅器に、Yb3+はファイバレーザーによく使われるイオンです。図4に各イオンのエネルギー準位図と発光の様子を示します。
Pr3+イオン:
Jはスピン軌道相互作用によりJ=L+S, L+S-1,・・・, L-Sまでの(2S+1)コに分裂します。Pr3+の場合はS=1、L=5ですのでJ=L+S=6, J=L+S-1=5, J=L-S=4までの3つに分裂し、L=5はアルファベットHに対応、2S+1=3ですので3H4, 3H5, 3H6の準位ができます。準位のエネルギーの大小はHundの規則によって決まります。Hundの規則では、①スピン多重度(2S+1)の大きい項、②全軌道角運動量Lの大きい項、③4f電子数が半分以下ではJが小さい項が、半分以上ではJが大きい項が安定です。3H4, 3H5, 3H6の場合は、①スピン多重度、②全軌道角運動量が同じで、電子数半分以下ですのでJが小さい順に安定になり、エネルギー準位図では下からエネルギーの低い3H4, 3H5, 3H6順に表示されます。3F2、1G4の準位はクーロン相互作用により分裂した基底状態より高いエネルギーの軌道です。
Er3+イオン:
S=3/2、L=6ですのでJ=15/2, 13/2, 11/2, 9/2の4つに分裂し、L=6はIに対応、2S+1=4ですので項記号は4I15/2, 4I13/2, 4I11/2, 4I9/2となります。エネルギーの大きさは、①スピン多重度、②全軌道角運動量は同じですので③4f電子が半数以上ではJが大きい方が安定のルールに従い4I15/2< 4I13/2< 4I11/2< 4I9/2になります。
Yb3+イオン:
S=1/2, L=3ですのでJ=7/2, 5/2に分裂し、L=3はFに対応、2S+1=2ですので2F7/2, 2F5/2と表記されます。エネルギーの大きさは、①スピン多重度、②全軌道角運動量は同じですので③4f電子が半数以上ではJが大きい方が安定のルールに従い2F7/2< 2F5/2になります。
■希土類イオンの発光
希土類イオンの発光はクーロン相互作用やスピン軌道相互作用により分裂した4f軌道間の電子遷移によって起こります。軌道間のエネルギー差に合った波長の光(980nm)を希土類イオンに照射すると図4のように基底状態の4f電子が光エネルギーを吸収して上位準位1G4(Pr3+), 4I9/2(Er3+), 2F5/2(Yb3+)へ励起されます。励起された電子は上位準位に短時間滞在した後下位準位に戻り、準位間のエネルギー差を光として放出します。Pr3+の場合は1G4と3H5のエネルギー差が波長1300nmの光に相当し、Er3+では4I13/2と4I15/2のエネルギー差が波長1550nmの光、Yb3+では2F5/2と2F7/2のエネルギー差が波長1030nmの光に相当します。Er3+を980nmの光で4I11/2へ励起した場合には非発光で4I13/2へ遷移した後1550nmの光を発光して4I15/2へ遷移します。このケースのように準位間の遷移は常に発光を伴うわけではなく、一般に、準位間のエネルギー差が小さい場合はフォノンとしてエネルギーを失い非発光遷移します。Er3+は1480nmの光で4I13/2へ直接励起して発光させることもできます。
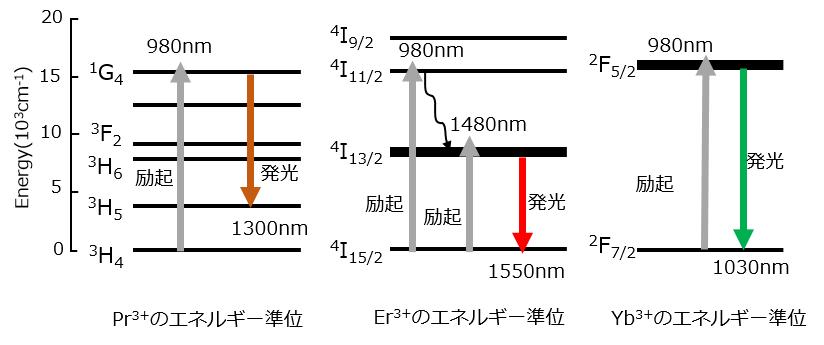
図4.希土類イオンのエネルギー準位と発光